La protéine “KIT” : une découverte majeure
En 1998, des chercheurs japonais découvrent à la surface des cellules de Cajal, la présence d’une protéine de la famille des récepteurs de tyrosine kinase, appelée “KIT” ou “CD 117”, anormalement activée chez une large majorité de patients présentant des tumeurs conjonctives développées à partir du tube digestif .
C’est à partir de cette date que ces tumeurs ont été rebaptisées “Tumeurs Stromales Gastro Intestinales” ou “GIST” qui est le terme anglo-saxon le plus communément employé pour désigner cette maladie.
La découverte de la protéine “KIT” a marqué donc un tournant décisif dans l’histoire des GIST. Nous savons désormais qu’elle est le point commun entre la plupart des malades développant ce type de tumeurs, même si d’autres protéines comme le “CD34” et le “PDGFRa” peuvent également être exprimées.
Avant 1998, la méconnaissance de cette protéine rendait le diagnostic de GIST très difficile à poser et les analyses pathologiques concluaient plus fréquemment aux diagnostics suivants :
- Léiomyome
- Léiomyosarcome
- Léiomyoblastome
- Schwannome bénin ou malin
De ce fait, nombreux sont les patients qui, dans les années 2000, ont souvent connu un premier diagnostic erroné.
- Mécanismes de fonctionnement de la protéine “KIT”
Pour la majorité des malades, c’est la mutation spontanée d’ un gène appelé “KIT” qui déclenche l’activation de la protéine “KIT”.
Lorsqu’elle est activée, cette protéine parfaitement autonome devient incontrôlable et empêche les cellules de Cajal incapables de freiner leur division, permettant ainsi au GIST de se développer. Dans un second temps, la protéine “KIT” transmet à l’intérieur de la cellule cancéreuse toute une série d’informations qui permettront à cette dernière de se multiplier, de grossir et de se propager dans l’organisme pour éventuellement former de nouvelles tumeurs : des métastases.
Toutefois, la nature de cette mutation diffère d’un patient à l’autre car elle peut survenir à différents niveaux du gène.
- Les mutations du gène “KIT”
Les GIST résultent généralement de la modification spontanée et incontrôlée des certaines informations génétiques contenues dans des portions du gène “KIT” appelées “exons”. C’est précisément la perte ou la modification d’informations sur l’un des exons qui va déclencher l’activation de la protéine “KIT” et aboutir à la formation de tumeurs GIST.
Dans le cas de GIST, les mutations surviennent essentiellement au niveau de :
- L’exon 11 (60% – 65% des patients)
- L’exon 9 (5% -10% des patients)
- Plus rarement au niveau des exons 13 et 17

Dans environ 15% des cas, les patients ne présentent pas de mutation du gène “KIT ” mais une mutation d’un autre récepteur appelé “PDGFRa”. La mutation la plus fréquente au niveau de ce gène se trouve au niveau de l’exon 18 (5 à 10% des patients).
Procédure de diagnostic des GIST
Si la présence de tumeurs peut être révélée par des examens d’imagerie comme le scanner, l’écho-endoscopie ou la fibroscopie , seule l’analyse pathologique de la tumeur permet de confirmer le diagnostic de GIST.
Cette analyse s’effectue généralement en trois temps :
- Analyse « macroscopique »
Examen à l’œil nu des prélèvements chirurgicaux. - Analyse « histologique »
Examen au microscope des prélèvements biopsiques ou opératoires. - Analyse « immunohistochimique »
Recherche et identification des protéines fabriquées par les cellules tumorales.
Cette analyse est indispensable car elle est la seule à pouvoir confirmer le diagnostic de GIST.
Recueil des tissus tumoraux
- Sur prélèvements opératoires
La plupart du temps, le diagnostic de GIST est confirmé à la suite d’une intervention chirurgicale. Lorsque le patient est opérable, le chirurgien procède à l’ablation de la tumeur et envoie l’ensemble du prélèvement au médecin pathologiste qui effectue les examens nécessaires à la confirmation du diagnostic.
- Sur ponction-biopsie
Si l’état du patient ne nécessite pas une intervention chirurgicale d’urgence, le médecin peut, suite à la découverte de la tumeur, prescrire :
- une ponction-biopsie sous écho-endoscopie,
- une biopsie profonde pendant la fibroscopie haute,
- ou une ponction sous scanner,
afin de connaître préalablement le diagnostic et d’envisager par la suite une prise en charge thérapeutique adaptée à la situation du malade : chirurgie ou traitement médicamenteux.
Recherche d’expression des protéines “KIT” et “DOG1”
Dans le cas des GIST, cette recherche est systématique et indispensable.
Son objectif est d’identifier la présence des protéines “KIT” et “DOG1” à la surface des cellules tumorales afin d’établir le diagnostic de GIST. L’expression de la protéine “DOG1” est plus spécifique que celle de “KIT” qui peut être observée dans de nombreuses autres tumeurs.
La recherche d’expression des protéines peut être réalisée par la majorité, sinon par tous les laboratoires d’anatomie pathologiques et se déroule en deux temps :
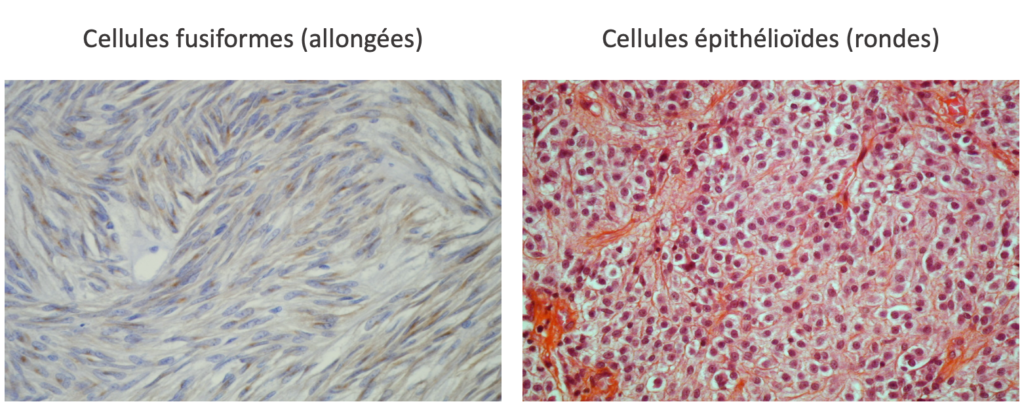
1. Observation des cellules tumorales au microscope : Analyse histologique
Il existe deux catégories de cellules GIST :
2. Application d’anticorps sur échantillons de tissus tumoraux : Analyse immunohistochimique
Deux réactions peuvent être observées :
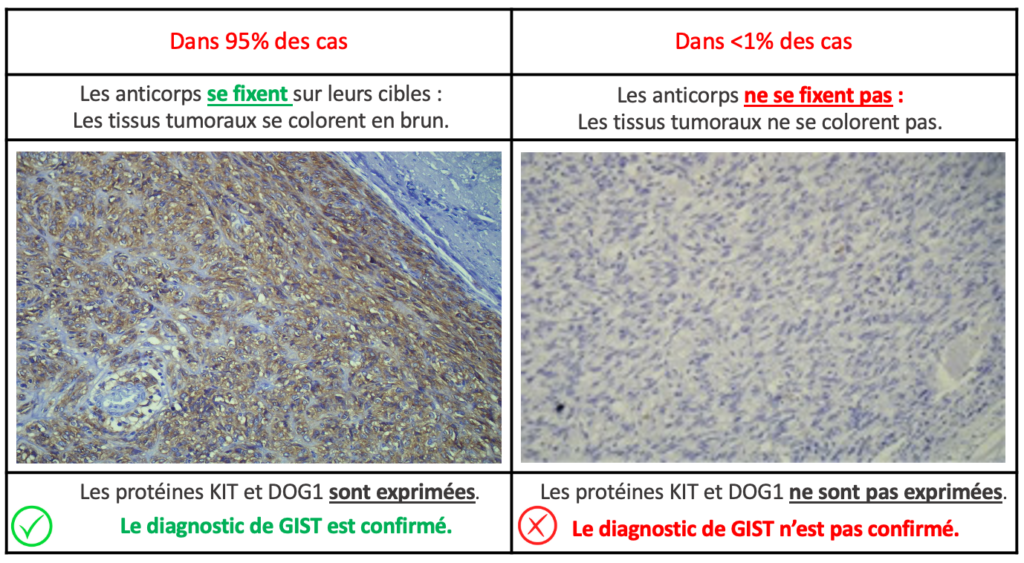
Important : Lorsque les protéines “KIT” et “DOG1” ne sont pas exprimées, les éventuelles mutations des gènes “KIT” ou “PDGFRa” doivent être recherchées pour confirmer ou non le diagnostic de GIST.
Près de 5% des tumeurs GIST sont négatives pour “KIT” alors qu’elles sont positives pour “DOG1”.
Il s’agit en général de GIST de l’estomac à cellules épithélioïdes, le plus souvent mutés au niveau de l’exon 18 du gène PDGFRa.
Définition du potentiel de malignité : évaluation du risque de rechute
Une fois le diagnostic de GIST établi, l’anatomopathologie détermine ensuite le potentiel de malignité de la tumeur afin d’évaluer le risque de rechute et/ou de métastases du patient après ablation totale de la tumeur.
Cette évaluation est réalisée à partir de la classification de Miettinen qui estime le risque de récidive et/ou de métastases selon les critères suivants :
- Taille de la tumeur
- Localisation
- Nombre de divisions cellulaires (mitoses)
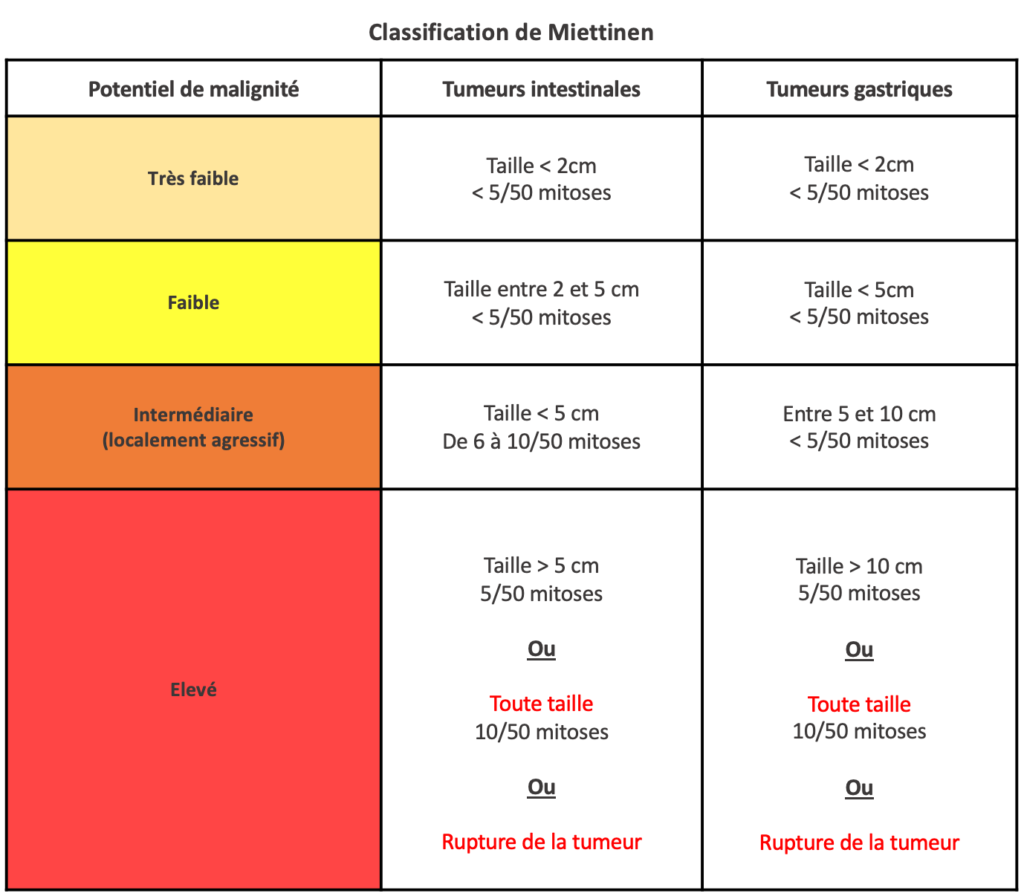
Attention : ce tableau n’est qu’un outil d’évaluation de “potentiel”, ce qui signifie qu’il ne garantit en aucun cas, ni l’absence de récidive ou de métastases chez les patients à très faible/faible risque ; ni la certitude d’une récidive ou de l’apparition de métastases chez les patients à risque intermédiaire ou élevé.
L’évaluation du potentiel de malignité est une étape déterminante du diagnostic car elle permettra de jauger la pertinence d’un traitement médicamenteux par imatinib adjuvant (c’est à dire après la chirurgie), afin de limiter les risques de récidive.
Recherche des mutations des gènes “KIT” et “PDGFRa”
La recherche de mutations de “KIT” et “PDGFRa” fait appel à des techniques très pointues, relevant de la biologie moléculaire.
La méthode consiste à prélever des échantillons d’ADN à partir des tissus tumoraux puis de les analyser afin de décrypter les informations génétiques de la cellule et d’identifier la mutation (l’exon) se trouvant à l’origine de ses dysfonctionnements.
Elle est indiquée, sinon indispensable, pour les GIST présentant un potentiel de malignité intermédiaire et élevé afin que l’oncologie puisse prescrire le traitement le mieux adapté aux caractéristiques de la tumeur. On sait par exemple que :
- les mutations de l’exon 11 du gène KIT sont de bon pronostic du fait de leur bonne sensibilité à l’imatinib,
- les mutations de l’exon 9 du gène KIT, moins sensibles à l’imatinib, nécessitent une double dose dès le démarrage.
- les mutations de l’exon 18 du gène PDGFRa sont insensibles à l’imatinib et doivent se voir proposer d’autres solutions de traitement dans le cadre d’essais cliniques.
Si votre tumeur est classée à risque intermédiaire ou à risque élevé de récidive, assurez-vous auprès de votre oncologue que la recherche de son statut mutationnel a bien été effectuée afin de recevoir le traitement le plus adapté à votre situation.
Confirmation du diagnostic par le réseau Rreps
Depuis 2010, en France, tout diagnostic de GIST doit être confirmé lors d’une seconde lecture réalisée par un médecin pathologiste affilié au “Réseau de référence en Pathologie des Sarcomes des tissus mous et des viscères” (Rreps), mis en place avec le soutien de l’institut National du Cancer (INCa), et comportant 22 centres de référence répartis sur l’ensemble du territoire français.
Compte-tenu de la rareté des GIST, cette seconde lecture s’avère indispensable pour pallier aux difficultés diagnostiques majeures rencontrées dans 10% des cas par le pathologiste.
Cette seconde lecture assure ainsi :
- Un immunologique-marquage de qualité avec l’utilisation systématique des deux anticorps “KIT” et “DOG1”;
- une définition du risque de rechute selon la classification de Miettinen modifiée ;
- une recherche des mutations du gène KIT et PDGFRa pour toutes les tumeurs GIST classées à risques intermédiaire ou élevés de malignité, rendue indispensable, pour aider à la décision d’un traitement adjuvant par imatinib.
Remerciements : Pr Jean-Michel Coindre, Institut Bergonié (Bordeaux).
